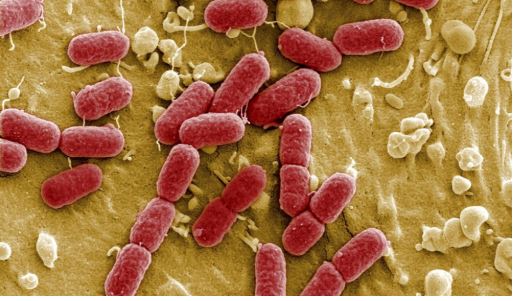
Si el descubrimiento de la penicilina en 1928 constituye uno de los hitos históricos de la medicina, las resistencias a los antibióticos se han convertido en los últimos años en una pesadilla. Cada año mueren más de 33.000 personas en Europa porque el abuso de estos fármacos ha convertido a muchos microorganismos en inmunes. La buena noticia es que si disminuye la presión de los antibióticos sobre los microbios “las resistencias son reversibles y las bacterias tienden a perderlas”, explica José Miguel Cisneros, jefe de servicio de enfermedades infecciosas del Hospital Virgen del Rocío de Sevilla.
Cisneros demuestra cómo un mejor uso de los antibióticos —no recetar los innecesarios y elegir los que tienen un menor impacto ecológico cuando sí lo son— desde los centros de atención primaria reduce las infecciones por bacterias multiresistentes. “Algunos estudios lo habían apuntado en el ámbito hospitalario, pero es la primera vez que una investigación hecha sobre una población de dos millones de personas muestra cómo se puede recuperar la eficacia de los antibióticos a nivel comunitario”, explica Cisneros.
La investigación se ha llevado a cabo en cuatro distritos sanitarios de Andalucía y en ella han participado 214 centros de salud y cinco hospitales —Virgen del Rocío, Virgen de la Macarena, San Juan de Dios del Aljarafe, Huelva y De la Merced— desde enero de 2012 hasta diciembre de 2017. Los dos primeros años sirvieron para preparar la intervención y los siguientes cuatro para implementar las medidas y monitorizar los resultados. Casi 1.400 facultativos —1.200 médicos de familia y 271 pediatras— han mantenido cinco veces al año asesorías clínicas y sesiones de formación en las que analizan sus hábitos de prescripción con un equipo de microbiólogos, infectólogos, epidemiólogos y farmacéuticos.
La dolencia elegida para la investigación fueron las infecciones en el tracto urinario causadas por la Escherichia coli, una bacteria común e incluso beneficiosa en la flora intestinal pero de la que el subtipo llamado “productoras de betalactamasas de espectro extendido (BLEE)” ha demostrado una mayor virulencia en el tracto urinario. Esta enzima descompone los antibióticos de primera elección y los hace inanes, obligando a utilizar los llamados carbapenem, lo que a su vez hace que otras bacterias se hagan también resistentes a ellos. El Centro Euorpeo de Control y Prevención de Enfermedades (ECDC) ha alertado del escenario “muy preocupante” que esto dibuja, ya que los carbapenem “son los últimos tratamientos disponibles y cuando no son efectivos, es extremadamente difícil o imposible tratar infecciones” que acaban con una elevada mortalidad.
La investigación monitorizó de 2014 a 2017 la prescripción de siete de los antibióticos más comunes y paralelamente, las Escherichia coli implicadas en más de 37.000 infecciones. Los resultados muestran una importante bajada en la prescripción inadecuada según las guías clínicas —del 36,5% al 26,3%— y un descenso del consumo de antibióticos como la ciprofloxacina (-15,9%), la cefalosporina (-22,6%) y la combinación de amoxicilina y ácido clauvánico (-2,2%). Como contrapartida, aumentó el de amoxicilina sola (el 22,2% más) y la fosfomicina trometamol (el 6,1%). “Se observa un notable descenso de los antibióticos con un mayor impacto ecológico sobre las bacterias, que son los que favorecen las resistencias, y un mejor uso de los más precisos y adecuados”, resume Cisneros.
Paralelamente, los aislamientos mostraron que la proporción de Escherichia coli productoras de BLEE identificadas se reducía del 7,1% al 5,5%, casi un tercio menos. En realidad, los resultados son más prometedores porque la incidencia de las bacterias resistentes venía de una sostenida tendencia al alza que el programa logró revertir: “Sobre los valores esperables, hemos conseguido una reducción del 65,6%”, explican los autores del estudio.
La virulenta temporada de la gripe del invierno de 2015, con un aumento de los casos del 21%, tuvo un impacto negativo en los resultados. El tratamiento de la enfermedad, causada por un virus, no requiere antibióticos, pero sí varias de las complicaciones que suele provocar. “Ese pico causó un notable aumento temporal del uso de todos los antibióticos, lo que ha mitigado en algo los avances logrados”, detalla Cisneros.
El estudio ha descubierto más áreas de mejora: “El hecho de que el programa no incluyera acciones de formación a pacientes o de mejora de las habilidades de comunicación de los médicos es una de sus debilidades”, recoge el artículo, que destaca que combinar estas estrategias “ofrece mejores resultados en la prescripción”. Los buenos resultados obtenidos han llevado a sus promotores a extenderlos ahora a “toda la red de atención primaria pública de Andalucía” y a incorporar también a “médicos, farmacéuticos y dentistas de la sanidad privada”, concluye el artículo.
La investigación, que ha recibido financiación del Instituto de Salud Carlos III, forma parte del Programa integral de prevención y control de las infecciones relacionadas con la asistencia sanitaria y uso apropiado de los antimicrobianos (Pirasoa) de la Junta de Andalucía.
El estómago de cualquier persona es un ecosistema sometido a una constante “guerra biológica” en la que las bacterias pugnan por hacerse un hueco. Como en toda guerra, hay momentos de tregua en los que la composición de la flora intestinal alcanza un equilibrio. Cuando esto ocurre “las Escherichia coli productoras de BLEE son muy minoritarias, porque hacerse resistentes a los antibióticos tiene un coste biológico que las hace peores competidoras frente a las Escherichia coli convencionales, que son beneficiosas para un sistema digestivo sano”, explica José Miguel Cisneros.
Introducir en este ambiente un antibiótico como la combinación de la amoxicilina y el ácido clauvánico cambia el equilibrio de fuerzas. “Las beneficiosas son arrasadas, lo que deja el espacio libre para las productoras de BLEE”, añade Cisneros. Este mecanismo, repetido a lo largo del tiempo, tiene un doble efecto negativo: favorece la aparición de nuevas bacterias resistentes y aumenta la incidencia de las que ya lo son, que al colonizar otras partes del organismo como las vías urinarias producirán graves infecciones.
“La amoxicilina sola, en cambio, no tiene este impacto. Por eso, recetarla cuando el ácido clauvánico no es necesario es una buena práctica médica. No rompe el equilibrio y, a medio y largo plazo, hará que las Escherichia coli beneficiosas vayan arrinconando a las resistentes”, relata el autor principal del estudio.
“Esto es solo un ejemplo, pero es la base de lo que hemos demostrado con el estudio. Con el uso adecuado del arsenal de antibióticos que tenemos es posible empezar a revertir el problema de las resistencias y recuperar todo el potencial de un fármaco fundamental para la medicina”, concluye Cisneros.
Con información de El País